الأوزون درع الأرض الهش
د.عدنان الظاهر
القسم الأول
أدرك العلماء المختصون وسائر البشر في السنوات الأخيرة الأهمية البالغة الخطورة لطبقة من الجزيئات النادرة نسبيا لمركب يعرف ( الأوزون ) وهو أحد مكونات الغلاف الجوي المحيط بالأرض . لقد تم الكشف في السنوات القليلة الماضية عن شدة حساسية طبقة الأوزون لفعاليات بني الأنسان التقنية والعواقب الوخيمة لأزالة هذه الطبقة من خلال أبحاث أجريت على تفاعلات كيميائية لم يفطن لها أحد من قبل , ذاك لأنها تجري على ارتفاع يزيد على العشرين ميلا فوق سطح الأرض . ولحسن الحظ جاءت هذه المعارف الجديدة في الوقت المناسب لتطوير فهم أعمق لطبقات الجو العليا ولأتخاذ الخطوات اللازمة لصيانة طبقة الأوزون من دمار غير مقصود .
كيمياء الأوزون في طبقات الجو العليا
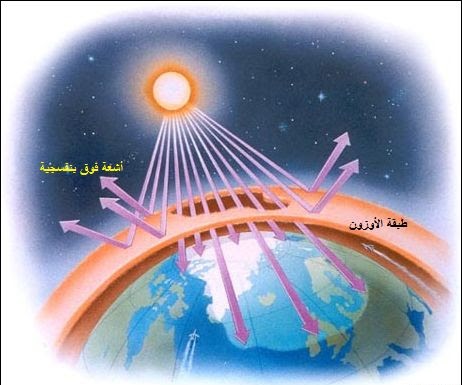
ملاحظة دقيقة لقوس قزح تبين أن في ضوء الشمس كافة أطياف اللون المرئي تتدرج ما بين اللون الأحمر واللون البنفسجي . وفضلا عن هذه الألوان المرئية فان في ضوء الشمس صنفين من أشعة غير مرئية هما الأشعة تحت الحمراء وتمتاز بطول موجاتها وصغر طاقاتها . ثم الأشعة فوق البنفسجية قصيرة الموجات شديدة الطاقات . لقد أدرك العلماء منذ قرن من الزمان أن الأشعة فوق البنفسجية القادمة من الشمس الينا تتوفر بغزارة بموجات أطوالها قريبة من 290 نانومترا ( النانو متر يساوي واحد بالبليون من المتر , أو أن المتر الواحد أكبر من النانو الواحد بألف مليون مرة ).أما الأشعة فوق البنفسجية ذات الأطوال الموجية الأقصر من 290 نانو مترا فانها لحسن الحظ لا تصل الينا مطلقا . ففي وصولها هلاك الحياة على سطح الأرض . ولسوف نرى لاحقا دور كل من غازي الأوكسجين والأوزون في منع وصول هذا الصنف من الأشعاعات عالية الطاقة الينا وذلك بامتصاصها والتحول بالتفاعلات الكيميائية من شكل الى آخر . أما العين البشرية فانها ترى الموجات التي تتراوح أطوالها بين 400 نانومترا ( اللون البنفسجي ) و 760 نانو مترا (اللون الأحمر ) .
أدرك العلماء أخيرا أن عدم وصول أشعة الشمس الأقصر طولا موجيا من 290 نانومترا الى سطح كرتنا الأرضية انما هو نتيجة لأحدى الخصائص التي يتميز بها الغلاف الجوي المحيط بالأرض , حيث يتعين على ضوء الشمس أن يخترق هذا الغلاف قبل أن يستطيع الوصول الى سطح الكرة الأرضية .
أدرك العالم البريطاني ( هارتلي ) في ثمانينيات القرن التاسع عشر أن التركيب ثلاثي الذرات للأوكسجين المعروف بالأوزون O3 يمتص أطوالا موجية معينة لضوء الشمس وبذا يمنعها من الوصول الى الأرض . وكان على حق اذ استنتج أن الأوزون الموجود في طبقات الجو العليا هو المركب الذي يحول دون وصول الأشعة فوق البنفسجية الأقصر طولا من 290 نانومترا والعالية الطاقة الى سطح الكوكب الأرضي .
ومع عصر الصواريخ والتجارب التي تقوم بها التوابع الأرضية والأقمار الصناعية ازدادت معرفة الأنسان بخصائص وظروف غلاف الأوزون الواقي . فلقد أصبح آواخر سبعينيات القرن الماضي واضحا أن معدل كمية الأوزون المتوفر في الغلاف الجوي هي أقل بقليل من واحد بالمليون من مجموع مكونات الهواء الجوي . وأن تركيز هذا الأوزون يتغير من يوم لآخر ومن فصل لفصل, بل ومن سنة لسنة . وأن الأوزون أكثر وفرة قرب القطبين منه عند خط الأستواء . وأنه في الشتاء أكثر منه في الصيف . ورغم قلة تركيز الموجود منه فان استمرارية وجود غلاف الأوزون الواقي بوضعه الراهن لعلى درجة قصوى من الأهمية بالنسبة للجنس البشري .
قبل أكثر من قرن من الزمان صمم ( سدني جابمان ) Sydney Chapman منظومة من التفاعلات الكيميائية لتفسيرالطرق التي يتكون بها غاز الأوزون وآليات تحطمه وكمية الموجود منه فعلا في الجو . ان أول خطوة في المجرى العام للتفاعلات هي امتصاص جزيئة غاز الأوكسجين للأشعة فوق البنفسجية الأقصر طولا موجيا من 242 نانومترا . والأوكسجين كما هو معلوم يشكل نسبة 21 % حجما من مجموع المكونات الغازية في الجو , وأنه شفاف تجاه الأشعة المرئية , أي أنه لا يمتصها فتمر خلاله كما يمر ضوء الشمس خلال الزجاج الكامل الشفافية والنقاء . وعندما تمتص جزيئة الأوكسجين الأشعة فوق البنفسجية القصيرة الأطوال الموجية فان الآصرة الكيميائية التي تربط ذرتي هذه الجزيئة تتكسر والناتج ذرتا أوكسجين فعالتان حسب المعادلة التالية :
1- جزيئة أوكسجين + اشعة فوق بنفسجية = ذرة أوكسجين + ذرة أوكسجين
وهاتان الذرتان النشطتان كيميائيا قادرتان على الأتحاد مع جزيئة أوكسجين أخرى لتكوين جزيئة أوزون حسب المعادلة التالية :
2- ذرة أوكسجين + جزيئة أوكسجين = جزيئة أوزون
جزيئة الأوزون هذه ذات طاقة عالية , وأن هذه الطاقة العالية تنتقل الى جزيئات الجو المحيط الأخرى عن طريق التصادمات فتتحول الى حرارة . وهذه الحرارة تلعب دورا رئيسا في تكوين قسم متميز في الغلاف الجوي يدعى ( ستراتوسفير ) Stratosphere على ارتفاع يتراوح بين 12 – 32 ميلا فوق سطح الأرض .
لا يستطيع الأوكسجين امتصاص أشعة الأطوال الموجية الأكبر من 242 نانومترا . غير أن الأوزون قادر على امتصاص هذا الصنف من الأشعة , ولكن ما هي عاقبة هذا الأمتصاص ؟؟ الآن يأتي دور كيمياء الأوزون . المعادلة الثالثة تفسر ما يحدث :
3- انفلاق جزيئة أوزون الى ذرة أوكسجين وجزيئة أوكسجين . أي أن المعادلة الثالثة هي عكس المعادلة رقم 2
جزيئة أوزون + أشعة فوق بنفسجية = ذرة أوكسجين + جزيئة أوكسجين
مرة أخرى تستطيع ذرة الأوكسجين المتكونة وفق المعادلة الثالثة أن تتحد مع جزيئة أوكسجين لتكوين جزيئة أوزون جديدة كما في المعادلة 2 .
يكون امتصاص الأوزون للأشعة فوق البنفسجية على أشده للأطوال الموجية التي تتراوح بين
250 – 280 نانومترا . غير أنه يعجز عجزا كاملا عن امتصاص موجات أشعة بطول
290 نانومترا وما فوق ذلك , اذ تنجح هذه الأشعاعات الشمسية في الوصول الينا واليها يرجع أصل وأسباب الحياة على الأرض .
وبسبب فعاليته الكيميائية يستطيع الأوزون أن يتفاعل مع ذرات الأوكسجين الأمر الذي يفضي الى تكوين جزيئتين من الأوكسجين حسب المعادلة الرابعة :
4- ذرة أوكسجين + جزيئة أوزون = جزيئتا أوكسجين
O3 + O = 2 O2
من هذه المعادلات جميعا نرى أن الأوزون دائم التكون تحت فعل أشعة الشمس فوق البنفسجية , وأنه دائم الأختفاء بتفاعله مع الأوكسجين الذري . وتدعى هذه الحالة بحالة الثبات المتوازن حيث يحتفظ الأوزون بنسبة جزيئة واحدة مقابل مليون جزيئة من الهواء الجوي .
الأوزون درع الأرض الهش
القسم الثاني
قدمت معادلات ( جابمان ) المارة الذكر والتي غالبا ما تسمى ( ميكانزم جابمان ) تفسيرات نوعية وأخرى كمية لدرع الأوزون ظلت مقبولة حتى مجيء عصر الفضاء . فمنذ أوائل ستينيات القرن الماضي تجمعت معلومات دقيقة حول شدة أشعة الشمس فوق البنفسجية كماأجريت أبحاث مختبرية حول طبيعة التفاعلات الكيميائية ذات الصلة , فضلا عن القياسات المباشرة لأوزون طبقة الستراتوسفير . بينت هذه الأنجازات الحديثة نسبيا أن ميكانزم جابمان غير شاملة , وأن أمورا هامة أخرى وتفاعلات كيميائية قد فاتت جابمان مما جعل تقديراته لكمية الأوزون الموجود فعلا ليست صحيحة . رأينا في القسم الأول ( معادلة رقم 1 ) كيف يتكون الأوزون , لكن تبقى موضوعة معرفة ألية ( ميكانزم ) ازالة هذا الأوزون . فهنالك تفاعلات كيميائية آخرى لم تكن معروفة من قبل تجري في الجو فتؤدي الى اتلاف الأوزون . أهمها قاطبة تلك التي تساهم فيها الجذور الحرة
Free Radicals . فلكل شيء سبب ودمار طبقة الأوزون له أسبابه كما سنرى .
الجذور الحرة والتفاعلات المتسلسلة
تم حوالي عام 1970 الكشف عن العملية المسؤولة عن أوسع ازالة وتدمير لغاز الأوزون . انها تتضمن تفاعلا كيميائيا مختلفا تماما عن تفاعلات جابمان : تفاعلا كيميائيا متسلسلا محتثا بوسيط مساعد . فما هو هذا الوسيط المساعد ؟؟
معلوم أن أهم مكونات الغلاف الجوي هما غاز الأوكسجين الجزيئي وغاز النايتروجين الجزيئي الذي يشكل نسبة 78 % حجما من مجموع غازات الجو . تتحد كمية ضئيلة من هذين الغازين فينتج غازان جديدان هما أوكسيد النايتروجين NO وغاز ثاني أوكسيد النايتروجين NO2 . ومعلوم أيضا أن أغلب مكونات الجو الأساسية فيها عدد زوجي من الألكترونات , لكن في كل من هذين الأوكسيدين عددا فرديا من الألكترونات . ففي الأوكسيد الأول خمسة عشر الكترونا فقط ( عدد فردي ) وفي الأوكسيد الثاني ثلاثة وعشرون ( كذلك عدد فردي ) . لذا فالغازان ينتميان الى صنف الجزيئات الفردية الألكترونات والتي تسمى ( الجذور الحرة ) . يمتاز معظم الجذور الحرة بالفعالية الكيميائية العالية وهذان الأوكسيدان أنموذجان لهذا الصنف من المركبات الكيميائية .
يهاجم أوكسيد النايتروجين NO غاز الأوزون فينتج غاز الأوكسجين وغاز ثاني أوكسيد النايتروجين NO2 كما في المعادلة 1
1- No + O3 = NO2 + O2
يتفاعل الجذر الحر NO2 المتكون حديثا حسب المعادلة أعلاه مع ذرة أوكسجين فيتكون الجذر الحر NO ثانية مع جزيئة أوكسجين حسب المعادلة رقم 2
2- NO2 + O = NO + O2
وحصيلة هذين التفاعلين كما هو مبين في هاتين المعادلتين زوال جزيئة أوزون O3 وذرة أوكسجين مع بقاء أوكسيد النايتروجين NO دونما أية خسارة في كميته , أي أنه بلعب هنا دور
العامل المساعد الحاث . لذلك تسمى دورة NO – NO2 بنظام العامل المساعد القادر على ازالة مئات الآلاف من جزيئات الأوزون قبل أن تنغلق هذه الدورة بدخول جذر حر جديد فيها كما تبينه المعادلة رقم 3
3- OH + NO2 = HNO3
وهنا يتحول غاز ثاني أوكسيد النايتروجين NO2 حامض النايتريك HNO3 .
دورة أخرى لجذور حرة جديدة
تم عام 1973 تشخيص سلسلة فعالة من جذور حرة يلعب فيها العامل المساعد دورا أساسيا . انها تتضمن ذرة كلور Cl وأوكسيد الكلور ClO وكلاهما جذر حر فردي الألكترونات كأوكسيدي النايتروجين ماري الذكر . يتفاعل الكلور الذري مع الأوزون فيكون الناتج أوكسيد الكلور وجزيئة أوكسجين كما في المعادلة رقم 4
4- Cl + O3 = ClO + O2
ثم يتفاعل أوكسيد الكلور الناتج في هذه المعادلة مع ذرة أوكسجين فيتكون الكلور ثانية مع جزيئة أوكسجين كما في معادلة 5
5- ClO + O = Cl + O2
واضح من سياق المعادلتين الأخيرتين 4 و 5 أن ذرة الكلور تلعب دور الوسيط الحاث أي دور العامل المساعد .
يستنتج من هذه المعادلات المارة الذكر أن أوكسيدي النايتروجين والكلور الذري وأوكسيد الكلور اذ تدخل في تفاعلات متسلسلة بوجود عامل مساعد قادرة على تهيئة الظروف الملائمة لأثبات أن تراكيز واطئة جدا من الجذور الحرة تستطيع أن تزيل أوزون الجو بالتفاعلات المتسلسلة المضاعفة والتي تتضمن في الأساس انتقال ذرة أوكسجين من جزيئة الى أخرى , وتحويل ذرة أوكسجين الى جزيئة أوكسجين . وأن جزيئات الأوكسجين في طبقة الستراتوسفير Stratosphere تتفكك فتعطي ذرات أوكسجين نتيجة امتصاصها للأشعة فوق البنفسجية القصيرة الموجات ( أقل من 242 نانومترا . أنظر المعادلة 1 في القسم الأول ) . ولما كان الأوكسجين يمثل 21 % حجما بالنسبة لمجموع مكونات الهواء فانه يمثل مصدرا لا ينضب لتزويد طبقات الجو العليا بذرات الأوكسجين الضرورية جدا لأستمرارية ادامة حدوث التفاعلات المتسلسلة بالعامل المساعد .
من الطبيعي أن يتبادر السؤال التالي الى الذهن : ما هو مصدر ذرات الكلور التي تلعب دور العامل المساعد في طبقة الستراتوسفير بالنسبة للتفاعل المتسلسل ( معادلة رقم 4 ) المسؤول عن ازالة الأوزون من هذه الطبقة ؟؟ يجيب الخبراء بكيمياء طبقات الجو العليا أن مصدر هذا الكلور هو مركب كلوريد المثيل CH3Cl الذي يتفكك فيعطي ذرة كلور تتصاعد الى الطبقات العليا من الجو فتلعب دورا أساسا في احدى دورات تدمير غاز الأوزون ( المعادلات 4 و 5 ) . أما أوكسيدا النايتروجين الداخلان في ميكانيكية ازالة الأوزون الأولى ( المعادلات 1 و 2 ) فانهما موجودان أصلا في طبقة الستراتوسفير . كما يمثل أوكسيد آخر للنايتروجين هو N2O والمسمى Nitrous Oxide مصدرا اضافيا لهما . فالتقديرات المعتمدة تشير الى أن في الجو من هذا الأوكسيد الأخير ثلاث جزيئات في كل عشرة ملاييين جزيئة هواء . جدير بالذكر أن هذا الأوكسيد بحد ذاته غير نشط كيميائيا , فالكتروناته زوجية العدد ( 22 الكترونا ) لكنه يعطي اذ يتفكك في طبقات الجو العليا نسبة بسيطة من غاز NO الشديد الفعالية والعامل المحرك المساعد للتفاعل المتسلسل الأول آنف الذكر ( المعادلات 1 و 2 ) . أما أصل هذا الأوكسيد الأضافي N2O فهو غاز النايتروجين الجوي العادي الذي تثبته النباتات بتحويله الى مركبات آزوتية تتفكك لاحقا , بفعل البكتريا على وجه الخصوص , فيكون هذا الأوكسيد أحد نواتج هذا التفكك . غيرأن ناتج هذا التفكك الغالب هو غاز النايتروجين . واضح أن هذه العمليات هي المسؤولة عن ثبات توازن كمية الأوكسيد N2O في الجو .
الأنسان والأوزون
90 % من مجموع الهواء الجوي يقع في المنطقة المسماة تروبوسفير Troposphere
التي يبلغ ارتفاعها عشرة أميال فوق سطح الكرة الأرضية , حيث لا غيم ولا مطر ولا سحاب فوق هذا الأرتفاع . وتلعب طبقة التروبوسفير دورا فعالا في حفظ الحياة على سطح كوكبنا الأرضي, ذاك لأن الغازات المختلفة بما فيها ملوثات الجو والغازات المدمرة للأوزون مثل أكاسيد النايتروجين تغسل أو أن تذوب في مطر ورياح منطقة التروبوسفير المحملة بالغيوم . وهذا يقف أمامها سدا حائلا يمنعها من الوصول الى طبقة الستراتوسفير الأعلى منها حيث يوجد أغلب أوزون الهواء . لذلك فالطائرات النفاثة العادية المصممة للتحليق في منطقة التروبوسفير حتى ارتفاع
مقداره 6 – 7 أميال فوق سطح الأرض لا يشكل أي خطر على حزام الأوزون . لماذا ؟؟ لأن رياح وأمطار هذه المنطقة تجرف أوكسيد النايتروجين NO الذي يتكون من اتحاد الأوكسجين مع النايتروجين بفعل الحرارة العالية داخل المحرك النفاث للطائرة . وهما أهم مكونات الهواء كما نعلم . اذا عجز هذا الغاز ذو الفعل المدمر للأوزون عن الوصول اليه في طبقة الستراتوسفير , فمن أين ترى يأتي الخطر على حزام الأوزون ؟؟ يأتيه الخطر من المصادر التالية :
أولا : طائرات السوبرسونيك المصممة للتحليقات العالية حيث تكون كثافة الهواء قليلة فتكون سرعة طيرانها عالية جدا . والأمثلة الشهيرة على ذلك طائرة الكونكورد الفرنسية – البريطانية وطائرات التوبوليف 144 الروسية المصممتان للتحليق على ارتفاع عشرة أميال ( 16 كيلومترا)
ينما تحلق طائرات الطيران المدني العادية على ارتفاع يتراوح بين 8 – 10 كيلومترات فقط .
أما طائرة البوينغ السوبرسونيك الأمريكية فالمفروض أن تحلق على ارتفاع اثني عشر ميلا وهوأعلى ارتفاع بالنسبة للطيران المدني حتى اليوم . اذن فهذه الطائرات التي تطير لمسافات طويلة في الأقسام السفلية من طبقة الستراتوسفير انما تمثل الخطر الأول على حزام الأوزون بما تنفثه من غاز NO ذي الدور المعلوم في ازالة الأوزون كيميائيا ( المعادلات 1 و 2 ) . لقد سبقت قبل قليل الأشارة الى أصل هذا الغاز وظروف تكونه في الحرارة العالية داخل المحركات النفاثة للطائرات . وبسبب انعدام السحب والأمطار في طبقة الستراتوسفير فأن ما يتكون من هذا الغاز في هذه المنطقة لا يزول , وتلكم وأيم الحق داهية الدواهي .
ثانيا : الصواريخ الحاملة لسفن الفضاء والمركبات الفضائية المصممة لأكثر من تحليق كوني واحد.
تستهلك في الغالب الوقود الصلب لقهر قوة الجاذبية الأرضية وتيسير صعود هذه المركبات والصواريخ الفائقة الوزن . ان أهم مكونات الوقود الصلب هي مادة بركلورات الأمونيوم Ammonium Perchlorate . وتشير التقديرات الحديثة الى أن طيرانا كونيا من هذا القبيل يخلف وراءه في طبقة الستراتوسفير مائة طن من غاز الكلور . ولقد رأينا الدور المخرب الذي تلعبه ذرات الكلور في ازالة غاز الأوزون ( المعادلات 4 و 5 ) .
ثالثا : مركبات الكاربون الحاوية على ذرات فلور وذرات كلور Chlorofluorocarbons
وأكثرها شهرة واستعمالا تلك التي تستعمل في أجهزة التبريد كالمركب CCl3F والمركب
CCl2F2 وكلاهما مركب غير نشط كيميائيا أي أنهما خاملان . لا يذوبان في الماء ويمتازان بسهولة تحولهما من الحالة السائلة الى الحالة الغازية وبالعكس . ولقد بينت تجارب اجريت أواخر عام 1973 في جامعة كالفورنيا الأمريكية في ارفاين أن هذه المركبات تتفكك على ارتفاع عشرين ميلا بتأثير أشعة الشمس فوق البنفسجية القصيرة معطية ذرات الكلور التي تلعب الدور المبادر في مسلسل دورة تخريب الأوزون كما رأينا سابقا ( المعادلات 4 و 5 ) .
يكا د اليوم لا يخلو بيت من هذه المركبات . فانها في الثلاجات وفي أجهزة تبريد المنازل صيفا وتدفئتها شتاء . وأنها تمزج مع سوائل أخرى تحت ضغط عال في قنانٍ معدنية محكمة الغلق , وعند فتحها للجو تتحول الى أبخرة أو غازات , كأجهزة رش أو بخ الشعر Hair Spray وقناني ازالة الروائح الكريهة من بيوت الراحة وسواها من الأمكنة . أما أجهزة تبريد مكائن السيارات فلا يستخدم فيها الا هذان المركبان سالفا الذكر .
هذا هو دور الإنسان ـ خالق التقنيات المعاصرة التي كانت يوما ما مجرد أضغاث أحلام ـ في تخريب طبقة الأوزون , درع الأرض الواقي الشديد الحساسية للجذور الحُرّة . ان مجرد معرفة ما يجري للأوزون في منطقة الستراتوسفير لا يكفي لدرء المخاطر المُحدِّقة به , بل ينبغي على الأنسان , وقد أدرك سر ومصادر الخطر , أن يسعى للحيلولة دون وقوع الكارثة . ويتطلب هذا الأمر تظافر جهود الجميع , فالسماء ملكٌ للبشرية مشتركٌ وكذلك طبقة الستراتوسفير : المسرح المأساوي العريض .
المصدر : Science and the Future PP. 191
Britannica Inc.
Encyclopedia of 1979 Yearbook
ملاحظة : هذا البحث هومستلة خاصة أرسلها لي المؤلف البروفسور فرانك رولاند أستاذ الكيمياء في جامعة كالفورنيا الأمريكية في إرفاين.